Nomenclatura
Os nomes dos ésteres são derivados do nome, radical hidrocarboneto a e do nome do ácido, em que em vez da terminação “ácido -óico” é usado o sufixo “at” (como nos nomes dos sais inorgânicos: carbonato de sódio, nitrato de cromo), por exemplo:

(Fragmentos de moléculas e fragmentos de nomes correspondentes são destacados na mesma cor.)
Os ésteres são geralmente considerados produtos de reação entre um ácido e um álcool, por exemplo, o propionato de butila pode ser considerado o resultado da reação entre o ácido propiônico e o butanol;
Se o nome trivial do ácido inicial for usado, a palavra “éster” será incluída no nome do composto, por exemplo, C 3 H 7 COOC 5 H 11 - éster amílico do ácido butírico.
Série homóloga

Isomeria
Os ésteres são caracterizados por três tipos de isomeria:
1. Isomeria da cadeia de carbono, começa no resíduo ácido com ácido butanóico, no resíduo álcool - com álcool propílico, por exemplo:
2. Isomeria da posição do grupo éster -CO-O-. Este tipo de isomeria começa com ésteres cujas moléculas contêm pelo menos 4 átomos de carbono, por exemplo:
3. Isomeria interclasse, os ésteres (alcanoatos de alquila) são isoméricos aos ácidos monocarboxílicos saturados; Por exemplo:
Para ésteres contendo um ácido insaturado ou um álcool insaturado, são possíveis mais dois tipos de isomerismo: isomerismo da posição da ligação múltipla; isomeria cis-trans.
Propriedades físicas
Os ésteres de homólogos inferiores de ácidos e álcoois são líquidos incolores, de baixo ponto de ebulição e com odor agradável; utilizados como aditivos aromáticos em produtos alimentícios e em perfumaria. Os ésteres não se dissolvem bem em água.
Métodos de obtenção
1. Extraído de produtos naturais
2. Interação de ácidos com álcoois (reações de esterificação); Por exemplo:

Propriedades quimicas
1. As reações mais típicas para ésteres são a hidrólise ácida ou alcalina (saponificação). Estas são reações inversas às reações de esterificação. Por exemplo:

2. Redução (hidrogenação) de éteres complexos, resultando na formação de álcoois (um ou dois); Por exemplo:

Os ésteres podem ser considerados derivados de ácidos nos quais o átomo de hidrogênio no grupo carboxila é substituído por um radical hidrocarboneto:
Nomenclatura.
Os ésteres recebem o nome dos ácidos e álcoois cujos resíduos participam de sua formação, por exemplo H-CO-O-CH3 - formato de metila, ou éster metílico de ácido fórmico; - acetato de etila ou éster etílico de ácido acético.
Métodos de obtenção.
1. Interação de álcoois e ácidos (reação de esterificação):
2. Interação de cloretos ácidos e álcoois (ou alcoolatos de metais alcalinos):
Propriedades físicas.
Os ésteres de ácidos e álcoois inferiores são líquidos mais leves que a água e com odor agradável. Apenas ésteres com menor número de átomos de carbono são solúveis em água. Os ésteres são altamente solúveis em álcool e éter distílico.
Propriedades quimicas.
1. A hidrólise dos ésteres é a reação mais importante deste grupo de substâncias. A hidrólise sob a influência da água é uma reação reversível. Para deslocar o equilíbrio para a direita, são usados álcalis:

2. A redução dos ésteres com hidrogênio leva à formação de dois álcoois:
3. Sob a influência da amônia, os ésteres são convertidos em amidas ácidas:
Gorduras. As gorduras são misturas de ésteres formadas pelo álcool tri-hídrico glicerol e ácidos graxos superiores. Fórmula geral de gorduras:

onde R são radicais de ácidos graxos superiores.
Na maioria das vezes, a composição das gorduras inclui ácidos palmítico e esteárico saturados e ácidos oleico e linoléico insaturados.
Obtenção de gorduras.
Atualmente, o único significado prático é obter gorduras de fontes naturais origem animal ou vegetal.
Propriedades físicas.
As gorduras formadas por ácidos saturados são sólidas e as gorduras insaturadas são líquidas. Todos são muito pouco solúveis em água e altamente solúveis em éter dietílico.
Propriedades quimicas.
1. A hidrólise ou saponificação das gorduras ocorre sob a influência da água (reversível) ou álcalis (irreversível):

A hidrólise alcalina produz sais de ácidos graxos superiores, chamados sabões.
2. A hidrogenação de gorduras é o processo de adição de hidrogênio aos resíduos de ácidos insaturados que constituem as gorduras. Nesse caso, os resíduos de ácidos insaturados se transformam em resíduos de ácidos saturados e as gorduras passam de líquidas a sólidas.
Dos nutrientes mais importantes – proteínas, gorduras e carboidratos – as gorduras possuem a maior reserva energética.
Derivados de ácidos carboxílicos ou inorgânicos nos quais o átomo de hidrogênio no grupo hidroxila é substituído por um radical são chamados de ésteres. Normalmente, a fórmula geral dos ésteres é denotada como dois radicais hidrocarbonetos ligados a um grupo carboxila - C n H 2n+1 -COO-C n H 2n+1 ou R-COOR’.
Nomenclatura
Os nomes dos ésteres são compostos pelos nomes do radical e do ácido com o sufixo “-at”. Por exemplo:
- CH3COOH- formato de metila;
- HCOOCH3- formato de etilo;
- CH 3 COOC 4 H 9- acetato de butilo;
- CH 3 -CH 2 -COO-C 4 H 9- butilpropionato;
- CH 3 -SO 4 -CH 3- sulfato de dimetila.
Nomes triviais para o ácido contido no composto também são usados:
- C 3 H 7 SOOS 5 H 11- éster amílico de ácido butírico;
- HCOOCH3- éster metílico de ácido fórmico;
- CH 3 -COO-CH 2 -CH(CH 3) 2- éster isobutil de ácido acético.

Arroz. 1. Fórmulas estruturais de ésteres com nomes.
Classificação
Dependendo da sua origem, os ésteres são divididos em dois grupos:
- ésteres de ácido carboxílico- contêm radicais hidrocarbonetos;
- ésteres de ácidos inorgânicos- incluir o restante sais minerais(C 2 H 5 OSO 2 OH, (CH 3 O)P(O)(OH) 2, C 2 H 5 ONO).
Os mais diversos são os ésteres de ácidos carboxílicos. Suas propriedades físicas dependem da complexidade de sua estrutura. Os ésteres de ácidos carboxílicos inferiores são líquidos voláteis com aroma agradável, enquanto os ésteres de ácidos carboxílicos superiores são sólidos. São compostos pouco solúveis que flutuam na superfície da água.
Os tipos de ésteres de ácido carboxílico são apresentados na tabela.
|
Visualizar |
Descrição |
Exemplos |
|
Ésteres de frutas |
Líquidos cujas moléculas não contêm mais de oito átomos de carbono. Eles têm um aroma frutado. Consistem em álcoois monohídricos e ácidos carboxílicos |
|
|
Líquidos (óleos) e sólidos contendo de nove a 19 átomos de carbono. Consistem em resíduos de glicerol e ácido carboxílico (graxo) |
Azeite - uma mistura de glicerina com resíduos de ácidos palmítico, esteárico, oleico e linoléico |
|
|
Sólidos com 15-45 átomos de carbono |
CH 3 (CH 2) 14 -CO-O-(CH 2) 29 CH 3-palmitato de miricila |

Arroz. 2. Cera.
Ésteres de ácidos carboxílicos são os principais componentes dos aromáticos óleos essenciais, que estão contidos em frutas, flores, bagas. Também incluído na cera de abelha.

Arroz. 3. Óleos essenciais.
Recibo
Os ésteres são preparados de várias maneiras:
- reação de esterificação de ácidos carboxílicos com álcoois:
CH 3 COOH + C 2 H 5 OH → CH 3 COOC 2 H 5 + H 2 O;
- reação de anidridos de ácido carboxílico com álcoois:
(CH 3 CO) 2 O + 2C 2 H 5 OH → 2CH 3 COOC 2 H 5 + H 2 O;
- reação de sais de ácidos carboxílicos com hidrocarbonetos halogenados:
CH 3 (CH 2) 10 COONa + CH 3 Cl → CH 3 (CH 2) 10 COOCH 3 + NaCl;
- reação de adição de ácidos carboxílicos a alcenos:
CH 3 COOH + CH 2 =CH 2 → CH 3 COOCH 2 CH 3 + H 2 O.
Propriedades
Propriedades quimicas os ésteres são devidos ao grupo funcional -COOH. As principais propriedades dos ésteres estão descritas na tabela.
Os ésteres são usados em cosmetologia, medicina e indústria alimentícia como agentes aromatizantes, solventes e enchimentos.
O que aprendemos?
Com o tópico da aula de química do 10º ano aprendemos o que são ésteres. São compostos que contêm dois radicais e um grupo carboxila. Dependendo da origem, podem conter resíduos de ácidos minerais ou carboxílicos. Os ésteres de ácidos carboxílicos são divididos em três grupos: gorduras, ceras, ésteres de frutas. São substâncias pouco solúveis em água, com baixa densidade e aroma agradável. Os ésteres reagem com álcalis, água, halogênios, álcoois e amônia.
Teste sobre o tema
Avaliação do relatório
Classificação média: 4.6. Total de avaliações recebidas: 88.
Se o ácido inicial for polibásico, então a formação de ésteres completos é possível - todos os grupos HO são substituídos, ou de ésteres ácidos - substituição parcial. Para ácidos monobásicos, apenas ésteres completos são possíveis (Fig. 1).
Arroz. 1. EXEMPLOS DE ÉSTERESà base de ácido inorgânico e carboxílico
Nomenclatura de ésteres.
O nome é criado da seguinte forma: primeiro é indicado o grupo R ligado ao ácido, depois o nome do ácido com o sufixo “at” (como nos nomes dos sais inorgânicos: carbono no sódio, nitrato no cromo). Exemplos na Fig. 2

Arroz. 2. NOMES DE ÉSTERES. Fragmentos de moléculas e fragmentos correspondentes de nomes são destacados na mesma cor. Os ésteres são geralmente considerados produtos de reação entre um ácido e um álcool, por exemplo, o propionato de butila pode ser considerado o resultado da reação entre o ácido propiônico e o butanol;
Se você usar trivial ( cm. NOMES TRIVIAIS DE SUBSTÂNCIAS) o nome do ácido inicial, então o nome do composto inclui a palavra “éster”, por exemplo, C 3 H 7 COOC 5 H 11 - éster amílico de ácido butírico.
Classificação e composição de ésteres.
Dentre os ésteres estudados e amplamente utilizados, a maioria são compostos derivados de ácidos carboxílicos. Os ésteres à base de ácidos minerais (inorgânicos) não são tão diversos, porque a classe dos ácidos minerais é menos numerosa que os ácidos carboxílicos (a variedade de compostos é uma das características distintas química orgânica).
Quando o número de átomos de C no ácido carboxílico e no álcool originais não excede 6–8, os ésteres correspondentes são líquidos oleosos incolores, na maioria das vezes com odor frutado. Eles formam um grupo de ésteres de frutas. Se um álcool aromático (contendo um núcleo aromático) estiver envolvido na formação de um éster, então tais compostos, via de regra, apresentam um odor floral e não frutado. Todos os compostos deste grupo são praticamente insolúveis em água, mas facilmente solúveis na maioria dos solventes orgânicos. Essas conexões são interessantes ampla variedade aromas agradáveis (Tabela 1), alguns deles foram primeiro isolados de plantas e posteriormente sintetizados artificialmente.
| Mesa 1. ALGUNS ÉSTERES, com aroma frutado ou floral (fragmentos dos álcoois originais na fórmula do composto e no nome estão destacados em negrito) | ||
| Fórmula Éster | Nome | Aroma |
| CH 3 COO C 4 H 9 | Butilo acetato | pera |
| C 3 H 7 COO Capítulo 3 | MetiloÉster de ácido butírico | maçã |
| C 3 H 7 COO C2H5 | EtiloÉster de ácido butírico | abacaxi |
| C 4 H 9 COO C2H5 | Etilo | carmesim |
| C 4 H 9 COO C 5 H 11 | Isoamiléster de ácido isovalérico | banana |
| CH 3 COO CH 2 C 6 H 5 | Benzil acetato | jasmim |
| C 6 H 5 COO CH 2 C 6 H 5 | Benzil benzoato | floral |
Quando o tamanho dos grupos orgânicos incluídos nos ésteres aumenta para C 15–30, os compostos adquirem a consistência de substâncias plásticas e facilmente amolecidas. Este grupo é chamado de ceras; geralmente são inodoros. A cera de abelha contém uma mistura de vários ésteres; um dos componentes da cera, que foi isolado e sua composição determinada, é o éster miricílico do ácido palmítico C 15 H 31 COOC 31 H 63. Cera chinesa (produto da excreção de insetos cochonilha) Ásia leste) contém éster cerílico de ácido cerotínico C 25 H 51 COOC 26 H 53. Além disso, as ceras também contêm ácidos carboxílicos e álcoois livres, que incluem grandes grupos orgânicos. As ceras não são umedecidas pela água e são solúveis em gasolina, clorofórmio e benzeno.
O terceiro grupo são as gorduras. Ao contrário dos dois grupos anteriores baseados em álcoois monohídricos ROH, todas as gorduras são ésteres formados a partir do álcool trihídrico glicerol HOCH 2 – CH (OH) – CH 2 OH. Os ácidos carboxílicos que constituem as gorduras geralmente têm uma cadeia de hidrocarbonetos com 9 a 19 átomos de carbono. As gorduras animais (manteiga de vaca, cordeiro, banha) são substâncias plásticas e fusíveis. Gorduras vegetais (azeitona, caroço de algodão, óleo de girassol) – líquidos viscosos. As gorduras animais consistem principalmente em uma mistura de glicerídeos de ácido esteárico e palmítico (Fig. 3A, B). Os óleos vegetais contêm glicerídeos de ácidos com um comprimento de cadeia de carbono ligeiramente mais curto: C 11 H 23 COOH láurico e C 13 H 27 COOH mirístico. (como os ácidos esteárico e palmítico, estes são ácidos saturados). Esses óleos podem ser armazenados ao ar por muito tempo sem alterar sua consistência, por isso são chamados de não secantes. Em contraste, o óleo de linhaça contém glicerídeo de ácido linoléico insaturado (Figura 3B). Quando aplicado em camada fina na superfície, esse óleo seca sob a influência do oxigênio atmosférico durante a polimerização ao longo de ligações duplas, formando-se um filme elástico insolúvel em água e solventes orgânicos. Baseado óleo de linhaça produzir óleo secante natural.

Arroz. 3. GLICERÍDEOS DE ÁCIDO ESTÁRICO E PALMÍTICO (A E B)– componentes da gordura animal. O glicerídeo do ácido linoléico (B) é um componente do óleo de linhaça.
Os ésteres de ácidos minerais (sulfatos de alquila, boratos de alquila contendo fragmentos de álcoois inferiores C 1–8) são líquidos oleosos, os ésteres de álcoois superiores (a partir de C 9) são compostos sólidos.
Propriedades químicas dos ésteres.
O mais característico dos ésteres de ácidos carboxílicos é a clivagem hidrolítica (sob a influência da água) da ligação éster em um ambiente neutro, que ocorre lentamente e acelera visivelmente na presença de ácidos ou bases; Os íons H + e HO – catalisam esse processo (Fig. 4A), com os íons hidroxila agindo de forma mais eficiente. A hidrólise na presença de álcalis é chamada de saponificação. Se você ingerir uma quantidade de álcali suficiente para neutralizar todo o ácido formado, ocorre a saponificação completa do éster. Este processo é realizado em escala industrial, neste caso o glicerol e os ácidos carboxílicos superiores (C 15–19) são obtidos na forma de sais de metais alcalinos, que são sabão (Fig. 4B). Fragmentos de ácidos insaturados contidos em óleos vegetais, como quaisquer compostos insaturados, podem ser hidrogenados, o hidrogênio se liga a ligações duplas e formam-se compostos semelhantes às gorduras animais (Fig. 4B). Usando esse método, as gorduras sólidas são produzidas industrialmente à base de óleo de girassol, soja ou milho. De produtos de hidrogenação óleos vegetais, misturado com gorduras animais naturais e vários aditivos alimentares, faça margarina.

O principal método de síntese é a interação de um ácido carboxílico e um álcool, catalisada pelo ácido e acompanhada pela liberação de água. Esta reação é o oposto daquela mostrada na Fig. 3A. Para que o processo prossiga na direção desejada (síntese de ésteres), a água é destilada (destilada) da mistura reacional. Através de estudos especiais utilizando átomos marcados, foi possível estabelecer que durante o processo de síntese, o átomo de O, que faz parte da água resultante, se desprende do ácido (marcado com uma moldura pontilhada vermelha), e não do álcool ( a opção não realizada é destacada com uma moldura pontilhada azul).
Usando o mesmo esquema, são obtidos ésteres de ácidos inorgânicos, por exemplo, nitroglicerina (Fig. 5B). Em vez de ácidos, podem ser utilizados cloretos de ácido. O método é aplicável tanto para ácidos carboxílicos (Fig. 5C) como para ácidos inorgânicos (Fig. 5D).
A interação de sais de ácido carboxílico com haletos de RCl também leva a ésteres (Fig. 5D); a reação é conveniente porque é irreversível - o sal inorgânico liberado é imediatamente removido do meio de reação orgânico na forma de um precipitado.
Uso de ésteres.
O formato de etila HCOOC 2 H 5 e o acetato de etila H 3 COOC 2 H 5 são utilizados como solventes para vernizes de celulose (à base de nitrocelulose e acetato de celulose).
Os ésteres à base de álcoois inferiores e ácidos (Tabela 1) são utilizados na indústria alimentícia para criar essências de frutas, e os ésteres à base de álcoois aromáticos na indústria de perfumes.
Polidores, lubrificantes, composições impregnantes para papel (papel encerado) e couro são feitos de ceras; também fazem parte de cremes cosméticos e pomadas medicinais.
As gorduras, juntamente com os carboidratos e as proteínas, compõem o conjunto necessário à nutrição produtos alimentícios, fazem parte de todas as células vegetais e animais, além disso, acumulando-se no corpo, desempenham o papel de reserva energética. Devido à sua baixa condutividade térmica, a camada de gordura protege bem os animais (especialmente animais marinhos - baleias ou morsas) da hipotermia.
As gorduras animais e vegetais são matérias-primas para a produção de ácidos carboxílicos superiores, detergentes e glicerol (Fig. 4), utilizados na indústria cosmética e como componente de diversos lubrificantes.
A nitroglicerina (Fig. 4) é um conhecido medicamento e uma substância explosiva, à base de dinamite.
Os óleos secantes são feitos de óleos vegetais (Fig. 3), que constituem a base das tintas a óleo.
Os ésteres de ácido sulfúrico (Fig. 2) são usados em síntese orgânica como reagentes alquilantes (introdução de um grupo alquil em um composto), e os ésteres de ácido fosfórico (Fig. 5) são usados como inseticidas, bem como aditivos para óleos lubrificantes.
Mikhail Levitsky
Os ésteres são termicamente instáveis: quando aquecido até 200 – 250 o C eles decompor em muito mais estável ácidos carboxílicos e alcenos, Por exemplo:
Se o primeiro átomo de carbono da porção álcool do éster tiver uma ramificação, então serão obtidos dois alcenos diferentes, e cada um deles pode ser obtido como dois cis- E transe- isômeros:
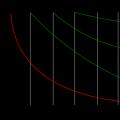
Os ésteres podem ser hidrolisados em ambientes ácidos, neutros e alcalinos. A reação é reversível e sua velocidade depende da concentração do ácido forte adicionado. As curvas cinéticas, isto é, curvas em coordenadas tempo-concentração, representam uma exponencial descendente para o éster e as mesmas exponenciais ascendentes para o álcool e o ácido carboxílico. Abaixo está um gráfico para a reação de hidrólise em visão geral:
Se o ácido não for adicionado, observa-se um processo autocatalítico: a princípio a hidrólise prossegue muito lentamente, mas forma-se um ácido carboxílico - um catalisador e o processo acelera, e depois de algum tempo sua velocidade cai novamente e a concentração do éster atinge equilíbrio. Esta concentração de equilíbrio, ceteris paribus, não é diferente da concentração de equilíbrio obtida durante a catálise com ácidos fortes. No entanto, o tempo para atingir a meia conversão (t 1/2 ) Muito maior:
Sob a influência de álcalis, os ésteres também são “hidrolisados”, mas aqui o álcali não é um catalisador, mas um reagente:
Os ésteres sofrem reações de transesterificação com álcoois e ácidos:
Para deslocar o equilíbrio no sentido da formação do éster alvo, o álcool, o reagente de partida, é tomado em grande excesso. Na transesterificação com ácido, é utilizado em grande excesso.
Ésteres reagem com amônia e aminas. O equilíbrio nessas reações é fortemente deslocado para a formação de amidas ácidas e alquilamidas: não é necessário excesso de amônia ou amina (!!!)
Os ésteres podem ser oxidados por agentes oxidantes fortes em ambiente ácido. Aparentemente, a hidrólise ocorre primeiro e apenas o álcool resultante é realmente oxidado. Por exemplo:
Os ésteres podem ser reduzidos a álcoois pelo sódio metálico em alguns álcoois. A reação foi proposta em 1903 e estudada detalhadamente em 1906 pelos químicos franceses Bouveau e Blanc e leva seu nome. Por exemplo:
Em duas etapas, os ésteres podem ser reduzidos a álcoois usando hidretos metálicos complexos. Na primeira etapa, no caso da utilização de borato de tetrahidreto de sódio, obtêm-se éster de ácido bórico e alcóxido de sódio, na segunda são hidrolisados em álcoois:
No caso da utilização de tetrahidretoaluminato de lítio, na primeira etapa obtêm-se alcoolatos de alumínio e lítio e, na segunda, também são hidrolisados em álcoois:
| Título do tópico ou seção do tópico | Página nº. |
| Ésteres. Definição. | |
| Classificação de ésteres | |
| Nomenclatura de ésteres | |
| Isomeria de ésteres | |
| Isômeros de ésteres interfuncionais | |
| Estrutura eletrônica e espacial de ésteres usando o exemplo do acetato de metila | |
| Métodos para produção de ésteres | |
| Preparação de ésteres pela reação de ácidos carboxílicos com alcenos. | |
| Preparação de ésteres pela reação de ácidos carboxílicos com alcinos. | |
| Preparação de ésteres pela interação de alcinos, monóxido de carbono e álcoois. | |
| A produção de ésteres pela interação de ácidos carboxílicos e álcoois é uma reação de esterificação. | |
| Preparação de ésteres pela interação de anidridos de cloro (halogênio) de ácidos carboxílicos e álcoois. | |
| Preparação de ésteres pela reação de haletos ácidos com alcoolatos. | |
| Preparação de ésteres pela interação de anidridos de ácidos carboxílicos e álcoois. | |
| Preparação de ésteres pela reação de anidridos de ácido carboxílico com alcoolatos | |
| Preparação de ésteres pela reação de anidridos e halogenetos de ácidos carboxílicos com fenóis. | |
| Preparação de ésteres pela reação de anidridos e halogenetos ácidos de ácidos carboxílicos com fenolatos (naftolatos). | |
| Preparação de ésteres pela interação de sais de ácidos carboxílicos e halogenetos de alquila | |
| Preparação de ésteres a partir de outros ésteres por reações de transesterificação ácida | |
| Preparação de ésteres a partir de outros ésteres por reações de transesterificação com álcool. | |
| Preparação de ésteres a partir de éteres pela reação deles com monóxido de carbono | |
| Propriedades físicas, aplicação e significado médico e biológico de ésteres | |
| Propriedades físicas dos ésteres | |
| Relação dos ésteres com a luz | |
| Estado físico dos ésteres | |
| A dependência dos pontos de fusão e ebulição dos ésteres do número de átomos de carbono neles e de sua estrutura. Tabela nº 1 | |
| Dependência dos pontos de ebulição dos ésteres da estrutura do radical de sua parte alcoólica. Tabela nº 2 | |
| Solubilidade e poder solvente de ésteres | |
| Solubilidade de ésteres em água, etanol e éter dietílico a 20 o C. Tabela nº 3 | |
| Capacidade solvente dos ésteres em relação a vernizes e tintas, bem como a sais inorgânicos | |
| Cheiro de ésteres. | |
| O cheiro dos ésteres, seu uso, ocorrência na natureza e propriedades tóxicas. Tabela nº 4 | |
| Significado médico e biológico dos ésteres | |
| Fórmulas de ésteres – medicamentos medicinais e biologicamente ativos | |
| Propriedades químicas dos ésteres | |
| Decomposição térmica de ésteres em ácidos carboxílicos e alcenos | |
| Hidrólise de ésteres em ambiente ácido. Curvas cinéticas. | |
| Hidrólise de ésteres em água. Curvas cinéticas de autocatálise. | |
| Reação de ésteres com álcalis. Curvas cinéticas. | |
| Reação de transesterificação de ésteres com álcoois e ácidos. | |
| A reação dos ésteres com amônia e aminas produz amidas ácidas. | |
| A reação de oxidação de ésteres com agentes oxidantes fortes em ambiente ácido. | |
| Reação de redução de ésteres a álcoois segundo Bouveau e Blanc | |
| Reação de redução de ésteres a álcoois usando hidretos metálicos complexos | |
| Contente |