Una reacción química es la transformación de una sustancia en otra.
Cualquier tipo al que pertenezcan reacciones químicas, se realizan a diferentes velocidades. Por ejemplo, las transformaciones geoquímicas en las entrañas de la Tierra (formación de hidratos cristalinos, hidrólisis de sales, síntesis o descomposición de minerales) tienen lugar durante miles, millones de años. Y reacciones como la combustión de pólvora, hidrógeno, salitre y sal de Berthollet se producen en fracciones de segundos.
La velocidad de una reacción química se refiere al cambio en las cantidades de reactivos (o productos de reacción) por unidad de tiempo. El concepto más utilizado velocidad de reacción promedio (Δc p) en el intervalo de tiempo.
v av = ± ∆C/∆t
Para productos ∆С > 0, para sustancias de partida -∆С< 0. Наиболее употребляемая единица измерения - моль на литр в секунду (моль/л*с).
La velocidad de cada reacción química depende de muchos factores: la naturaleza de las sustancias que reaccionan, la concentración de las sustancias que reaccionan, los cambios en la temperatura de reacción, el grado de molienda de las sustancias que reaccionan, los cambios de presión y la introducción de un catalizador. al medio de reacción.
Naturaleza de los reactivos afecta significativamente la velocidad de una reacción química. Como ejemplo, consideremos la interacción de algunos metales con un componente permanente: el agua. Definamos los metales: Na, Ca, Al, Au. El sodio reacciona con el agua en temperatura normal muy violentamente, con secreción gran cantidad calor.
2Na + 2H2O = 2NaOH + H2 + Q;
El calcio reacciona menos vigorosamente con el agua a temperaturas normales:
Ca + 2H2O = Ca(OH)2 + H2 + Q;
El aluminio reacciona con el agua ya a temperaturas elevadas:
2Al + 6H2O = 2Al(OH)z + ZH2-Q;
Y el oro es uno de los metales inactivos; no reacciona con el agua ni a temperaturas normales ni elevadas.
La velocidad de una reacción química depende directamente de concentraciones de reactivos . Entonces, para la reacción:
C2H4 + 3O2 = 2CO2 + 2H2O;
La expresión para la velocidad de reacción es:
v = k**[O 2 ] 3 ;
Donde k es la constante de velocidad de una reacción química, numéricamente igual a la velocidad de esta reacción, siempre que las concentraciones de los componentes que reaccionan sean iguales a 1 g/mol; los valores de [C 2 H 4 ] y [O 2 ] 3 corresponden a las concentraciones de las sustancias reaccionantes elevadas a la potencia de sus coeficientes estequiométricos. Cuanto mayor sea la concentración de [C 2 H 4 ] u [O 2 ], más colisiones de moléculas de estas sustancias por unidad de tiempo y, por tanto, mayor será la velocidad de la reacción química.
Las velocidades de las reacciones químicas, por regla general, también dependen directamente sobre la temperatura de reacción . Naturalmente, al aumentar la temperatura, aumenta la energía cinética de las moléculas, lo que también conduce a mayores colisiones de moléculas por unidad de tiempo. Numerosos experimentos han demostrado que con cada cambio de temperatura de 10 grados, la velocidad de reacción cambia de 2 a 4 veces (regla de Van't Hoff):

donde V T 2 es la velocidad de reacción química en T 2; V ti es la velocidad de reacción química en T 1 ; g es el coeficiente de temperatura de la velocidad de reacción.
 Influencia grado de molienda de sustancias
la velocidad de reacción también depende directamente. Cuanto más finas son las partículas de las sustancias que reaccionan, más entran en contacto entre sí por unidad de tiempo y mayor es la velocidad de la reacción química. Por lo tanto, por regla general, las reacciones entre sustancias o soluciones gaseosas avanzan más rápido que en el estado sólido.
Influencia grado de molienda de sustancias
la velocidad de reacción también depende directamente. Cuanto más finas son las partículas de las sustancias que reaccionan, más entran en contacto entre sí por unidad de tiempo y mayor es la velocidad de la reacción química. Por lo tanto, por regla general, las reacciones entre sustancias o soluciones gaseosas avanzan más rápido que en el estado sólido.
Los cambios de presión afectan la velocidad de reacción entre sustancias en estado gaseoso. Al estar en un volumen cerrado a temperatura constante, la reacción avanza a una velocidad de V 1. Si en este sistema aumentamos la presión (por lo tanto, reducimos el volumen), aumentarán las concentraciones de las sustancias que reaccionan, la colisión de sus moléculas por unidad de tiempo aumentará, la velocidad de reacción aumentará a V 2 (v 2 > v 1).
catalizadores Son sustancias que cambian la velocidad de una reacción química, pero permanecen sin cambios una vez finalizada la reacción química. La influencia de los catalizadores en la velocidad de una reacción se llama catálisis. Los catalizadores pueden acelerar un proceso dinámico químico y ralentizarlo. Cuando las sustancias que interactúan y el catalizador se encuentran en el mismo estado de agregación, hablamos de catálisis homogénea, y con catálisis heterogénea, los reactivos y el catalizador se encuentran en diferentes estados de agregación. El catalizador y los reactivos forman un complejo intermedio. Por ejemplo, para una reacción:
El catalizador (K) forma un complejo con A o B - AK, VK, que libera K al interactuar con una partícula libre A o B:
AK + B = AB + K
VK + A = VA + K;
blog.site, al copiar material total o parcialmente, se requiere un enlace a la fuente original.
Reacción rápida está determinado por un cambio en la concentración molar de uno de los reactivos:
V = ± ((C 2 - C 1) / (t 2 - t 1)) = ± (CC / Dt)
Donde C 1 y C 2 son concentraciones molares de sustancias en los tiempos t 1 y t 2, respectivamente (signo (+) - si la velocidad está determinada por el producto de reacción, signo (-) - por la sustancia de partida).
Las reacciones ocurren cuando las moléculas de sustancias que reaccionan chocan. Su velocidad está determinada por el número de colisiones y la probabilidad de que conduzcan a una transformación. El número de colisiones está determinado por las concentraciones de las sustancias que reaccionan y la probabilidad de una reacción está determinada por la energía de las moléculas que chocan.
Factores que influyen en la velocidad de las reacciones químicas.
1. La naturaleza de las sustancias reaccionantes. La naturaleza de los enlaces químicos y la estructura de las moléculas de los reactivos juegan un papel importante. Las reacciones proceden en la dirección de la destrucción de enlaces menos fuertes y la formación de sustancias con enlaces más fuertes. Por tanto, para romper los enlaces en las moléculas de H2 y N2, es necesario altas energías; tales moléculas son ligeramente reactivas. Romper enlaces en moléculas altamente polares (HCl, H 2 O) requiere menos energía y la velocidad de reacción es mucho mayor. Las reacciones entre iones en soluciones de electrolitos ocurren casi instantáneamente.
Ejemplos
El flúor reacciona explosivamente con el hidrógeno en temperatura ambiente, el bromo reacciona con el hidrógeno lentamente y cuando se calienta.
El óxido de calcio reacciona vigorosamente con el agua, liberando calor; Óxido de cobre: no reacciona.
2. Concentración. A medida que aumenta la concentración (el número de partículas por unidad de volumen), las colisiones de moléculas de sustancias que reaccionan ocurren con mayor frecuencia: la velocidad de reacción aumenta.
Ley de acción de masas (K. Guldberg, P. Waage, 1867)
La velocidad de una reacción química es directamente proporcional al producto de las concentraciones de los reactivos.
AA+bB+. . . ® . . .
- [A] a [B] b . . .
La constante de velocidad de reacción k depende de la naturaleza de los reactivos, la temperatura y el catalizador, pero no depende de las concentraciones de los reactivos.
El significado físico de la constante de velocidad es que es igual a la velocidad de reacción en concentraciones unitarias de los reactivos.
Para reacciones heterogéneas, la concentración de la fase sólida no se incluye en la expresión de la velocidad de reacción.
3. Temperatura. Por cada aumento de 10°C en la temperatura, la velocidad de reacción aumenta de 2 a 4 veces (regla de Van't Hoff). A medida que la temperatura aumenta de t 1 a t 2, el cambio en la velocidad de reacción se puede calcular mediante la fórmula:
| |
|
(t 2 - t 1) / 10 |
| Vt 2 / Vt 1 | = gramo | |
(donde Vt 2 y Vt 1 son las velocidades de reacción a temperaturas t 2 y t 1, respectivamente; g es el coeficiente de temperatura de esta reacción).
La regla de Van't Hoff sólo es aplicable en un rango de temperatura estrecho. Más precisa es la ecuación de Arrhenius:
- e-Ea/RT
Dónde
A es una constante que depende de la naturaleza de los reactivos;
R es la constante universal de los gases;
Ea es la energía de activación, es decir la energía que deben tener las moléculas en colisión para que la colisión conduzca a una transformación química.
Diagrama de energía de una reacción química.
| Reacción exotérmica | Reacción endotérmica |
A - reactivos, B - complejo activado (estado de transición), C - productos.
Cuanto mayor es la energía de activación Ea, más aumenta la velocidad de reacción al aumentar la temperatura.
4. Superficie de contacto de sustancias reaccionantes. Para sistemas heterogéneos (cuando las sustancias se encuentran en diferentes estados de agregación), cuanto mayor es la superficie de contacto, más rápida se produce la reacción. La superficie de los sólidos se puede aumentar triturándolos y de las sustancias solubles disolviéndolas.
5. Catálisis. Las sustancias que participan en las reacciones y aumentan su velocidad, permaneciendo sin cambios al final de la reacción, se denominan catalizadores. El mecanismo de acción de los catalizadores está asociado con una disminución de la energía de activación de la reacción debido a la formación de compuestos intermedios. En catálisis homogénea los reactivos y el catalizador constituyen una fase (están en el mismo estado de agregación), con catálisis heterogénea - diferentes fases(se encuentran en diferentes estados de agregación). En algunos casos, la aparición de procesos químicos indeseables se puede ralentizar drásticamente añadiendo inhibidores al medio de reacción (el "fenómeno" catálisis negativa").
Las reacciones químicas ocurren con diferentes velocidades. Algunas de ellas se completan por completo en pequeñas fracciones de segundo, otras se llevan a cabo en minutos, horas, días; Se conocen reacciones que requieren varios años para ocurrir. Además, la misma reacción puede transcurrir rápidamente en algunas condiciones, por ejemplo, a temperaturas elevadas, y lentamente en otras, por ejemplo, al enfriar; Además, la diferencia en la velocidad de una misma reacción puede ser muy grande.
Al considerar la velocidad de una reacción química, es necesario distinguir entre reacciones que ocurren en un sistema homogéneo (reacciones homogéneas) y reacciones que ocurren en un sistema heterogéneo (reacciones heterogéneas).
DEFINICIÓN
Sistema en química se acostumbra llamar a la sustancia o conjunto de sustancias de que se trata. En este caso, el sistema se opone. ambiente externo- sustancias que rodean el sistema.
Hay sistemas homogéneos y heterogéneos. Homogéneo Un sistema que consta de una fase se llama. heterogéneo- un sistema que consta de varias fases. Fase es una parte de un sistema separada de sus otras partes por una interfaz, durante la transición a través de la cual las propiedades cambian abruptamente.
Un ejemplo de sistema homogéneo es cualquier mezcla de gases de todos los gases a temperaturas no muy altas presiones disolverse indefinidamente entre sí) o una solución de varias sustancias en un disolvente.
Ejemplos de sistemas heterogéneos incluyen los siguientes sistemas: agua con hielo, una solución saturada con sedimento, carbón y azufre en una atmósfera de aire.
Si una reacción ocurre en un sistema homogéneo, entonces ocurre en todo el volumen de este sistema. Si se produce una reacción entre sustancias que forman un sistema heterogéneo, entonces sólo puede ocurrir en la interfaz entre las fases que forman el sistema. En este sentido, la velocidad de una reacción homogénea y la velocidad de una reacción heterogénea se definen de manera diferente.
DEFINICIÓN
Velocidad de reacción homogénea. es la cantidad de una sustancia que reacciona o se forma durante una reacción por unidad de tiempo por unidad de volumen del sistema.
Velocidad de reacción heterogénea. es la cantidad de sustancia que reacciona o se forma durante una reacción por unidad de tiempo por unidad de superficie de la fase.
Ambas definiciones se pueden escribir en forma matemática. Introduzcamos la siguiente notación: υ homogéneo - velocidad de reacción en un sistema homogéneo; υ h eterógeno - velocidad de reacción en un sistema heterogéneo; n - número de moles de cualquiera de las sustancias resultantes de la reacción; V es el volumen del sistema; tiempo t; S es el área de superficie de la fase en la que ocurre la reacción; Δ - signo de incremento (Δn = n 2 -n 1; Δt = t 2 -t 1). Entonces
υ homogéneo = Δn / (V× Δt);
υ heterógeno = Δn / (S× Δt).
La primera de estas ecuaciones se puede simplificar. La relación entre la cantidad de una sustancia (n) y el volumen (V) del sistema es la concentración molar (c) de la sustancia: c=n/V, de donde Δc=Δn/V y finalmente:
υ homogéneo = Δc / Δt.
Ejemplos de resolución de problemas
EJEMPLO 1
| Ejercicio | Haga las fórmulas de dos óxidos de hierro si las fracciones masivas de hierro que contienen son 77,8% y 70,0%. |
| Solución |
Encontremos la fracción de masa en cada uno de los óxidos de cobre: ω1 (O) = 100% - ω1 (Fe) = 100% - 77,8% = 22,2%; ω2 (O) = 100% - ω2 (Fe) = 100% - 70,0% = 30,0%. Denotemos el número de moles de elementos incluidos en el compuesto por "x" (hierro) e "y" (oxígeno). Entonces, la relación molar se verá así (valores relativos masas atómicas, tomado de tabla periódica DI. Mendeleev redondeó a números enteros): x:y = ω 1 (Fe)/Ar(Fe) : ω 1 (O)/Ar(O); x:y = 77,8/56: 22,2/16; x:y = 1,39: 1,39 = 1:1. Esto significa que la fórmula del primer óxido de hierro será FeO. x:y = ω2 (Fe)/Ar(Fe) : ω2 (O)/Ar(O); x:y = 70/56: 30/16; x:y = 1,25: 1,875 = 1: 1,5 = 2: 3. Esto significa que la fórmula del segundo óxido de hierro será Fe 2 O 3. |
| Respuesta | FeO, Fe2O3 |
EJEMPLO 2
| Ejercicio | Escribe una fórmula para el compuesto de hidrógeno, yodo y oxígeno si las fracciones de masa de los elementos que lo componen son: ω(H) = 2,2%, ω(I) = 55,7%, ω(O) = 42,1%. |
| Solución | La fracción de masa del elemento X en una molécula de composición NX se calcula mediante la siguiente fórmula: ω (X) = n × Ar (X) / M (HX) × 100%. Denotemos el número de moles de elementos incluidos en el compuesto como "x" (hidrógeno), "y" (yodo), "z" (oxígeno). Entonces, la relación molar se verá así (los valores de masas atómicas relativas tomados de la Tabla Periódica de D.I. Mendeleev se redondean a números enteros): x:y:z = ω(H)/Ar(H) : ω(I)/Ar(I) : ω(O)/Ar(O); x:y:z= 2,2/1: 55,7/127: 42,1/16; x:y:z= 2,2: 0,44: 2,63 = 5: 1: 6. Esto significa que la fórmula del compuesto de hidrógeno, yodo y oxígeno será H 5 IO 6. |
| Respuesta | H5IO6 |
Sistemas. Pero este valor no refleja la posibilidad real de que ocurra la reacción, su velocidad y mecanismo.
Para comprender completamente una reacción química, es necesario tener conocimiento de qué patrones de tiempo existen durante su implementación, es decir, velocidad de reacción química y su mecanismo detallado. Estudiar la velocidad y el mecanismo de la reacción. cinética química– la ciencia de proceso quimico.
Desde el punto de vista cinética química, las reacciones se pueden clasificar en simple y complejo.
Reacciones simples– procesos que ocurren sin la formación de compuestos intermedios. Según el número de partículas que participan en él, se dividen en monomolecular, bimolecular, trimolecular. La colisión de más de 3 partículas es poco probable, por lo que las reacciones trimoleculares son bastante raras y se desconocen las reacciones de cuatro moléculas. Reacciones complejas– procesos que constan de varias reacciones elementales.
Cualquier proceso avanza a su velocidad inherente, que puede estar determinada por los cambios que ocurren durante un cierto período de tiempo. Promedio velocidad de reacción química expresado cambiando la cantidad de sustancia norte sustancia consumida o recibida por unidad de volumen V por unidad de tiempo t.
υ = ± dn/ dt· V
Si una sustancia se consume, entonces le ponemos un signo “-”; si se acumula, le ponemos un signo “+”.
A volumen constante:
υ = ± corriente continua/ dt,
Unidad de velocidad de reacción mol/l s
En general, υ es un valor constante y no depende de qué sustancia involucrada en la reacción estemos monitoreando.
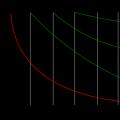
La dependencia de la concentración de un reactivo o producto del tiempo de reacción se presenta en la forma curva cinética, que se parece a:
Es más conveniente calcular υ a partir de datos experimentales si las expresiones anteriores se transforman en la siguiente expresión:
Ley de acción de masas. Orden y constante de velocidad de reacción.
Una de las formulaciones ley de acción de masas suena así: La velocidad de una reacción química elemental homogénea es directamente proporcional al producto de las concentraciones de los reactivos.
Si el proceso en estudio se representa en la forma:
a A + b B = productos
entonces la velocidad de una reacción química se puede expresar ecuación cinética:
υ = k [A] a [B] b o
υ = k·C a A ·C b B
Aquí [ A] Y [B] (C A YC B) - concentraciones de reactivos,
un yb– coeficientes estequiométricos de una reacción simple,
k– constante de velocidad de reacción.
Significado químico de la cantidad. k- Este reacción de velocidad en concentraciones únicas. Es decir, si las concentraciones de las sustancias A y B son iguales a 1, entonces υ = k.
Hay que tener en cuenta que en procesos químicos complejos los coeficientes un yb no coinciden con los estequiométricos.
La ley de acción de masas se cumple si se cumplen una serie de condiciones:
- La reacción se activa térmicamente, es decir. energía del movimiento térmico.
- La concentración de reactivos se distribuye uniformemente.
- Las propiedades y condiciones del medio ambiente no cambian durante el proceso.
- Las propiedades del medio ambiente no deben afectar k.
A procesos complejos ley de acción de masas no se puede aplicar. Esto puede explicarse por el hecho de que un proceso complejo consta de varias etapas elementales, y su velocidad no estará determinada por la velocidad total de todas las etapas, sino solo por una etapa más lenta, que se llama limitando.
Cada reacción tiene su propia orden. Definir orden privada (parcial) por reactivo y orden general (completa). Por ejemplo, al expresar la velocidad de una reacción química para un proceso
a A + b B = productos
υ = k·[ A] a·[ B] b
a– orden por reactivo A
b — ordenar por reactivo EN
Procedimiento general a + b = norte
Para procesos simples el orden de reacción indica el número de especies reaccionantes (coincide con los coeficientes estequiométricos) y toma valores enteros. Para procesos complejos el orden de reacción no coincide con los coeficientes estequiométricos y puede ser cualquiera.
Determinemos los factores que influyen en la velocidad de la reacción química υ.
Dependencia de la velocidad de reacción de la concentración de reactivos.
determinado por la ley de acción de masas: υ = k[ A] a·[ B] b
Es obvio que al aumentar las concentraciones de reactivos, υ aumenta, porque aumenta el número de colisiones entre sustancias que participan en el proceso químico. Además, es importante tener en cuenta el orden de la reacción: si norte=1 para algún reactivo, entonces su velocidad es directamente proporcional a la concentración de esta sustancia. Si para algún reactivo norte=2, luego duplicar su concentración conducirá a un aumento en la velocidad de reacción en 2 2 = 4 veces, y aumentar la concentración 3 veces acelerará la reacción en 3 2 = 9 veces.
Velocidad de reacción química
Velocidad de reacción química- cambio en la cantidad de una de las sustancias reaccionantes por unidad de tiempo en una unidad de espacio de reacción. Es un concepto clave en cinética química. La velocidad de una reacción química es siempre un valor positivo, por lo tanto, si está determinada por la sustancia de partida (cuya concentración disminuye durante la reacción), entonces el valor resultante se multiplica por −1.
Por ejemplo para la reacción:
la expresión de velocidad se verá así:
. La velocidad de una reacción química en un momento dado es proporcional a las concentraciones de los reactivos elevadas a potencias iguales a sus coeficientes estequiométricos.Para reacciones elementales, el exponente de la concentración de cada sustancia suele ser igual a su coeficiente estequiométrico; para reacciones complejas, esta regla no se observa. Además de la concentración, los siguientes factores influyen en la velocidad de una reacción química:
- la naturaleza de los reactivos,
- la presencia de un catalizador,
- temperatura (regla de Van't Hoff),
- presión,
- Área de superficie de sustancias que reaccionan.
Si consideramos la reacción química más simple A + B → C, notaremos que instante La velocidad de una reacción química no es constante.
Literatura
- Kubasov A. A. Cinética química y catálisis.
- Prigogine I., Defey R. Termodinámica química. Novosibirsk: Nauka, 1966. 510 p.
- Yablonsky G.S., Bykov V.I., Gorban A.N., Modelos cinéticos de reacciones catalíticas, Novosibirsk: Nauka (departamento sib.), 1983. - 255 p.
Fundación Wikimedia. 2010.
- Dialectos galeses del inglés
- Sierra (serie de películas)
Vea qué es "Velocidad de una reacción química" en otros diccionarios:
TASA DE REACCIÓN QUÍMICA- el concepto básico de cinética química. Para reacciones homogéneas simples, la velocidad de una reacción química se mide por el cambio en el número de moles de la sustancia reaccionada (a un volumen constante del sistema) o por el cambio en la concentración de cualquiera de las sustancias de partida... Grande diccionario enciclopédico
TASA DE REACCIÓN QUÍMICA- el concepto básico de química. cinética, que expresa la relación entre la cantidad de sustancia que reacciona (en moles) y el período de tiempo durante el cual ocurrió la interacción. Dado que las concentraciones de los reactivos cambian durante la interacción, la velocidad suele ser... Gran Enciclopedia Politécnica
velocidad de reacción química- una cantidad que caracteriza la intensidad de una reacción química. La velocidad de formación de un producto de reacción es la cantidad de este producto como resultado de una reacción por unidad de tiempo por unidad de volumen (si la reacción es homogénea) o por... ...
velocidad de reacción química- el concepto básico de cinética química. Para reacciones homogéneas simples, la velocidad de una reacción química se mide por el cambio en el número de moles de la sustancia reaccionada (a un volumen constante del sistema) o por el cambio en la concentración de cualquiera de las sustancias de partida... diccionario enciclopédico
Velocidad de reacción química- una cantidad que caracteriza la intensidad de una reacción química (ver Reacciones químicas). La velocidad de formación de un producto de reacción es la cantidad de este producto resultante de una reacción por unidad de tiempo por unidad de volumen (si... ...
TASA DE REACCIÓN QUÍMICA- básico concepto de quimica cinética. Para reacciones homogéneas simples de S. x. r. medido por el cambio en el número de moles de reaccionados en va (con un volumen constante del sistema) o por el cambio en la concentración de cualquiera de los in va iniciales o productos de reacción (si el volumen del sistema...
MECANISMO DE REACCIÓN QUÍMICA- Para reacciones complejas formadas por varias. etapas (reacciones simples o elementales), un mecanismo es un conjunto de etapas, como resultado de las cuales los materiales de partida se convierten en productos. Las moléculas pueden actuar como intermediarias en estas reacciones... ... Ciencias Naturales. diccionario enciclopédico
Reacciones de sustitución nucleofílica- (ing. reacción de sustitución nucleofílica) reacciones de sustitución en las que el ataque lo lleva a cabo un reactivo nucleofílico que lleva un par de electrones solitario. El grupo saliente en las reacciones de sustitución nucleofílica se llama nucleófugo. Todo...Wikipedia
Reacciones químicas- transformación de unas sustancias en otras, diferentes de las originales composición química o edificio. Numero totalátomos de cada elemento dado, así como ellos mismos elementos químicos, las sustancias constituyentes, permanecen en R. x. sin alterar; este R. x... Gran enciclopedia soviética
velocidad de dibujo - velocidad lineal Movimiento del metal a la salida de la matriz, m/s. En las máquinas trefiladoras modernas, la velocidad de trefilado alcanza entre 50 y 80 m/s. Sin embargo, incluso al trefilar alambre, la velocidad no suele superar los 30-40 m/s. En… … Diccionario enciclopédico de metalurgia