La velocidad de las reacciones químicas. Equilibrio químico
Plan:
1. El concepto de velocidad de una reacción química.
2. Factores que afectan la velocidad de una reacción química.
3. Equilibrio químico. Factores que influyen en el equilibrio de desplazamiento. El principio de Le Chatelier.
Las reacciones químicas ocurren con a diferentes velocidades. Las reacciones ocurren muy rápidamente. soluciones acuosas. Por ejemplo, si drena soluciones de cloruro de bario y sulfato de sodio, inmediatamente precipitado blanco sulfato de bario. El etileno decolora rápidamente, pero no instantáneamente, el agua con bromo. El óxido se forma lentamente en los objetos de hierro, aparece placa en los productos de cobre y bronce y el follaje se pudre.
La ciencia estudia la velocidad de una reacción química, además de identificar su dependencia de las condiciones del proceso. cinética química.
Si las reacciones ocurren en un medio homogéneo, por ejemplo, en una solución o en fase gaseosa, entonces la interacción de los reactivos ocurre en todo el volumen. Este tipo de reacciones se denominan homogéneo.
Si se produce una reacción entre sustancias en diferentes estados de agregación (por ejemplo, entre un sólido y un gas o líquido) o entre sustancias que no son capaces de formar un medio homogéneo (por ejemplo, entre dos líquidos inmiscibles), entonces tiene lugar sólo en la superficie de contacto de las sustancias. Este tipo de reacciones se denominan heterogéneo.
υ de una reacción homogénea está determinada por el cambio en la cantidad de sustancia por unidad por unidad de volumen:
υ =Δn / Δt ∙V
donde Δ n es el cambio en el número de moles de una de las sustancias (más a menudo la original, pero también puede ser un producto de reacción), (mol);
V – volumen de gas o solución (l)
Dado que Δ n / V = ΔC (cambio de concentración), entonces
υ =Δ C / Δt (mol/l∙ s)
υ de una reacción heterogénea está determinada por el cambio en la cantidad de sustancia por unidad de tiempo en una unidad de superficie de contacto de sustancias.
υ =Δn / Δt ∙ S
donde Δ n – cambio en la cantidad de sustancia (reactivo o producto), (mol);
Δt – intervalo de tiempo (s, min);
S – superficie de contacto de sustancias (cm 2, m 2)
¿Por qué las velocidades de diferentes reacciones no son las mismas?
Para que comience una reacción química, las moléculas de las sustancias que reaccionan deben chocar. Pero no todas las colisiones resultan en una reacción química. Para que una colisión dé lugar a una reacción química, las moléculas deben tener una energía suficientemente alta. Las partículas que pueden sufrir una reacción química al chocar se llaman activo. Tienen un exceso de energía en comparación con la energía promedio de la mayoría de las partículas: energía de activación. E acto. Hay muchas menos partículas activas en una sustancia que con energía promedio, por lo que para que comiencen muchas reacciones, se debe proporcionar algo de energía al sistema (un destello de luz, calentamiento, choque mecánico).
Barrera energética (valor mi acto) es diferente para diferentes reacciones, cuanto más bajo es, más fácil y rápida avanza la reacción.
2. Factores que influyen en υ(número de colisiones de partículas y su eficiencia).
1) Naturaleza de los reactivos: su composición, estructura => energía de activación
▪ cuanto menos mi acto, mayor υ;
Si mi acto < 40 кДж/моль, то это значит, что значительная часть столкновений между частицами реагирующих веществ приводит к их взаимодействию, и скорость такой реакции очень большая. Все реакции ионного обмена протекают практически мгновенно, т.к. в этих реакциях участвуют разноименнозаряженные частицы, и энергия активации в этих случаях ничтожно мала.
Si mi acto> 120 kJ/mol, esto significa que sólo una pequeña fracción de las colisiones entre partículas que interactúan conducen a una reacción. La tasa de tales reacciones es muy baja. Por ejemplo, oxidación del hierro o
el curso de la reacción de síntesis de amoníaco en temperatura normal casi imposible de notar.
Si mi acto tienen valores intermedios (40 – 120 kJ/mol), entonces la velocidad de tales reacciones será promedio. Tales reacciones incluyen la interacción del sodio con agua o etanol, la decoloración del agua con bromo con etileno, etc.
2) Temperatura: en t por cada 10 0 C, υ 2-4 veces (regla de van't Hoff).
υ 2 = υ 1 ∙ γ Δt/10
En t, el número de partículas activas (s mi acto) y sus colisiones activas.
Tarea 1. La velocidad de una determinada reacción a 0 0 C es igual a 1 mol/l ∙ h, el coeficiente de temperatura de la reacción es 3. ¿Cuál será la velocidad de esta reacción a 30 0 C?
υ 2 = υ 1 ∙ γ Δt/10
υ 2 =1∙3 30-0/10 = 3 3 =27 mol/l∙h
3) Concentración: cuanto más, más a menudo ocurren colisiones y υ. A temperatura constante para la reacción mA + nB = C según la ley de acción de masas:
υ = k ∙ C UN metro ∙ C B norte
donde k es la constante de velocidad;
C – concentración (mol/l)
Ley de acción de masas:
La velocidad de una reacción química es proporcional al producto de las concentraciones de las sustancias que reaccionan, tomadas en potencias iguales a sus coeficientes en la ecuación de reacción.
Z.d.m. no tiene en cuenta la concentración de sustancias reaccionantes en estado sólido, porque Reaccionan en las superficies y sus concentraciones suelen permanecer constantes.
Tarea 2. La reacción procede de acuerdo con la ecuación A + 2B → C. ¿Cuántas veces y cómo cambiará la velocidad de reacción cuando la concentración de la sustancia B aumente 3 veces?
Solución:υ = k ∙ C A m ∙ C B n
υ = k ∙ C A ∙ C B 2
υ 1 = k ∙ una ∙ segundo 2
υ 2 = k ∙ una ∙ 3 en 2
υ 1 / υ 2 = a ∙ en 2 / a ∙ 9 en 2 = 1/9
Respuesta: aumentará 9 veces
Para sustancias gaseosas, la velocidad de reacción depende de la presión.
Cuanto mayor sea la presión, mayor será la velocidad.
4) catalizadores– sustancias que cambian el mecanismo de reacción, reducen mi acto => υ .
▪ Los catalizadores permanecen sin cambios una vez completada la reacción.
▪ Las enzimas son catalizadores biológicos, proteínas por naturaleza.
▪ Inhibidores – sustancias que ↓ υ
5) Para reacciones heterogéneas, υ también depende:
▪ sobre el estado de la superficie de contacto de las sustancias reaccionantes.
Compárese: se vertieron volúmenes iguales de solución de ácido sulfúrico en 2 tubos de ensayo y al mismo tiempo se dejó caer un clavo de hierro en uno y limaduras de hierro en el otro. La molienda de un sólido conduce a un aumento en el número de moléculas que pueden reaccionar simultáneamente. . Por tanto, en el segundo tubo de ensayo la velocidad de reacción será mayor que en el primero.
Una reacción química es la transformación de una sustancia en otra.
Cualquiera que sea el tipo de reacciones químicas con las que se lleven a cabo a diferentes velocidades. Por ejemplo, las transformaciones geoquímicas en las entrañas de la Tierra (formación de hidratos cristalinos, hidrólisis de sales, síntesis o descomposición de minerales) tienen lugar durante miles, millones de años. Y reacciones como la combustión de pólvora, hidrógeno, salitre y sal de Berthollet se producen en fracciones de segundos.
La velocidad de una reacción química se refiere al cambio en las cantidades de sustancias reaccionantes (o productos de reacción) por unidad de tiempo. El concepto más utilizado velocidad de reacción promedio (Δc p) en el intervalo de tiempo.
v av = ± ∆C/∆t
Para productos ∆С > 0, para sustancias de partida -∆С< 0. Наиболее употребляемая единица измерения - моль на литр в секунду (моль/л*с).
La velocidad de cada reacción química depende de muchos factores: la naturaleza de las sustancias que reaccionan, la concentración de las sustancias que reaccionan, los cambios en la temperatura de reacción, el grado de molienda de las sustancias que reaccionan, los cambios de presión y la introducción de un catalizador. al medio de reacción.
Naturaleza de los reactivos afecta significativamente la velocidad de una reacción química. Como ejemplo, consideremos la interacción de algunos metales con un componente permanente: el agua. Definamos los metales: Na, Ca, Al, Au. El sodio reacciona muy violentamente con el agua a temperaturas normales, liberando gran cantidad calor.
2Na + 2H2O = 2NaOH + H2 + Q;
El calcio reacciona menos vigorosamente con el agua a temperaturas normales:
Ca + 2H2O = Ca(OH)2 + H2 + Q;
El aluminio reacciona con el agua ya a temperaturas elevadas:
2Al + 6H2O = 2Al(OH)z + ZH2-Q;
Y el oro es uno de los metales inactivos; no reacciona con el agua ni a temperaturas normales ni elevadas.
La velocidad de una reacción química depende directamente de concentraciones de reactivos . Entonces, para la reacción:
C2H4 + 3O2 = 2CO2 + 2H2O;
La expresión para la velocidad de reacción es:
v = k**[O 2 ] 3 ;
Donde k es la constante de velocidad de una reacción química, numéricamente igual a la velocidad de esta reacción, siempre que las concentraciones de los componentes que reaccionan sean de 1 g/mol; los valores de [C 2 H 4 ] y [O 2 ] 3 corresponden a las concentraciones de las sustancias reaccionantes elevadas a la potencia de sus coeficientes estequiométricos. Cuanto mayor sea la concentración de [C 2 H 4 ] u [O 2 ], más colisiones de moléculas de estas sustancias por unidad de tiempo y, por tanto, mayor será la velocidad de la reacción química.
Las velocidades de las reacciones químicas, por regla general, también dependen directamente sobre la temperatura de reacción . Naturalmente, al aumentar la temperatura, aumenta la energía cinética de las moléculas, lo que también conduce a mayores colisiones de moléculas por unidad de tiempo. Numerosos experimentos han demostrado que con cada cambio de temperatura de 10 grados, la velocidad de reacción cambia de 2 a 4 veces (regla de Van't Hoff):

donde V T 2 es la velocidad de reacción química en T 2; V ti es la velocidad de reacción química en T 1 ; g es el coeficiente de temperatura de la velocidad de reacción.
 Influencia grado de molienda de sustancias
la velocidad de reacción también depende directamente. Cuanto más finas son las partículas de las sustancias que reaccionan, más entran en contacto entre sí por unidad de tiempo y mayor es la velocidad de la reacción química. Por lo tanto, por regla general, las reacciones entre sustancias o soluciones gaseosas avanzan más rápido que en el estado sólido.
Influencia grado de molienda de sustancias
la velocidad de reacción también depende directamente. Cuanto más finas son las partículas de las sustancias que reaccionan, más entran en contacto entre sí por unidad de tiempo y mayor es la velocidad de la reacción química. Por lo tanto, por regla general, las reacciones entre sustancias o soluciones gaseosas avanzan más rápido que en el estado sólido.
Los cambios de presión afectan la velocidad de reacción entre sustancias en estado gaseoso. Al estar en un volumen cerrado a temperatura constante, la reacción avanza a una velocidad de V 1. Si en este sistema aumentamos la presión (por lo tanto, reducimos el volumen), las concentraciones de las sustancias que reaccionan aumentarán, la colisión de sus moléculas aumentará. por unidad de tiempo aumentará, la velocidad de reacción aumentará a V 2 (v 2 > v 1).
catalizadores Son sustancias que cambian la velocidad de una reacción química, pero permanecen sin cambios una vez finalizada la reacción química. La influencia de los catalizadores en la velocidad de una reacción se llama catálisis. Los catalizadores pueden acelerar un proceso dinámico químico y ralentizarlo. Cuando las sustancias que interactúan y el catalizador se encuentran en el mismo estado de agregación, hablamos de catálisis homogénea, y con catálisis heterogénea, los reactivos y el catalizador se encuentran en diferentes estados de agregación. El catalizador y los reactivos forman un complejo intermedio. Por ejemplo, para una reacción:
El catalizador (K) forma un complejo con A o B - AK, VK, que libera K al interactuar con una partícula libre A o B:
AK + B = AB + K
VK + A = VA + K;
blog.site, al copiar material total o parcialmente, se requiere un enlace a la fuente original.
Objetivo del trabajo: estudio de la velocidad de una reacción química y su dependencia de varios factores: la naturaleza de los reactivos, la concentración, la temperatura.
Las reacciones químicas ocurren a diferentes velocidades. Velocidad de reacción química Se llama cambio en la concentración de un reactivo por unidad de tiempo. Es igual al número de eventos de interacción por unidad de tiempo por unidad de volumen para una reacción que ocurre en un sistema homogéneo (para reacciones homogéneas), o por unidad de superficie de interfaz para reacciones que ocurren en un sistema heterogéneo (para reacciones heterogéneas).
Velocidad de reacción promedio v promedio. en el intervalo de tiempo desde t 1 antes t 2 está determinada por la relación:
Dónde C 1 Y C 2– concentración molar de cualquier participante de la reacción en puntos temporales t 1 Y t 2 respectivamente.
El signo “-” antes de la fracción se refiere a la concentración de las sustancias de partida, Δ CON < 0, знак “+” – к концентрации продуктов реакции, ΔCON > 0.
Los principales factores que influyen en la velocidad de una reacción química: la naturaleza de los reactivos, su concentración, presión (si hay gases involucrados en la reacción), temperatura, catalizador, área de interfaz para reacciones heterogéneas.
La mayoría de las reacciones químicas son procesos complejos que ocurren en varias etapas, es decir. que consta de varios procesos elementales. Las reacciones elementales o simples son reacciones que ocurren en un solo paso.
Para reacciones elementales, la dependencia de la velocidad de reacción de la concentración se expresa mediante la ley de acción de masas.
A temperatura constante, la velocidad de una reacción química es directamente proporcional al producto de las concentraciones de las sustancias que reaccionan, tomadas en potencias iguales a los coeficientes estequiométricos.
Para la reacción en vista general
a A + b B… → c C,
según la ley de acción de masas v expresado por la relación
v = К∙с(А) а ∙ с(В) b,
Dónde California) Y s(B)– concentraciones molares de los reactivos A y B;
A– constante de velocidad de esta reacción, igual a v, Si c(A)a=1 y c(B)b=1, y dependiendo de la naturaleza de los reactivos, temperatura, catalizador y área de interfaz para reacciones heterogéneas.
La expresión de la velocidad de reacción en función de la concentración se llama ecuación cinética.
En el caso de reacciones complejas, la ley de acción de masas se aplica a cada etapa individual.
Para reacciones heterogéneas, la ecuación cinética incluye sólo las concentraciones de sustancias gaseosas y disueltas; si, para quemar carbón
C (k) + O 2 (g) → CO 2 (g)
la ecuación de velocidad tiene la forma
v = K∙s(O 2)
Algunas palabras sobre la molecularidad y el orden cinético de la reacción.
Concepto "molecularidad de la reacción" se aplica sólo a reacciones simples. La molecularidad de una reacción caracteriza el número de partículas que participan en una interacción elemental.
Existen reacciones mono, bi y trimoleculares, en las que participan una, dos y tres partículas, respectivamente. La probabilidad de que tres partículas choquen al mismo tiempo es pequeña. Se desconoce el proceso elemental de interacción de más de tres partículas. Ejemplos de reacciones elementales:
N 2 O 5 → NO + NO + O 2 (monomolecular)
H 2 + I 2 → 2HI (bimolecular)
2NO + Cl 2 → 2NOCl (trimolecular)
La molecularidad de las reacciones simples coincide con el orden cinético general de la reacción. El orden de la reacción determina la naturaleza de la dependencia de la velocidad de la concentración.
El orden cinético general (total) de una reacción es la suma de los exponentes de las concentraciones de los reactivos en la ecuación de velocidad de reacción, determinada experimentalmente.
A medida que aumenta la temperatura, aumenta la velocidad de la mayoría de las reacciones químicas. La dependencia de la velocidad de reacción de la temperatura está determinada aproximadamente por la regla de Van't Hoff.
Por cada aumento de 10 grados en la temperatura, la velocidad de la mayoría de las reacciones aumenta de 2 a 4 veces.
donde y son la velocidad de reacción, respectivamente, a temperaturas t 2 Y t 1 (t2>t1);
γ es el coeficiente de temperatura de la velocidad de reacción, este es un número que muestra cuántas veces aumenta la velocidad de una reacción química cuando la temperatura aumenta en 10 0.
Utilizando la regla de Van't Hoff, sólo es posible estimar aproximadamente el efecto de la temperatura sobre la velocidad de reacción. Es factible una descripción más precisa de la dependencia de la velocidad de reacción de la temperatura en el marco de la teoría de activación de Arrhenius.
Uno de los métodos para acelerar una reacción química es la catálisis, que se lleva a cabo utilizando sustancias (catalizadores).
catalizadores- estas son sustancias que cambian la velocidad de una reacción química debido a la participación repetida en el intermedio interacción química con los reactivos de reacción, pero después de cada ciclo de interacción intermedia restablecen su composición química.
El mecanismo de acción del catalizador se reduce a una disminución de la energía de activación de la reacción, es decir. reduciendo la diferencia entre la energía promedio de las moléculas activas (complejo activo) y la energía promedio de las moléculas de las sustancias de partida. La velocidad de la reacción química aumenta.
Reacción rápida está determinado por un cambio en la concentración molar de uno de los reactivos:
V = ± ((C 2 - C 1) / (t 2 - t 1)) = ± (CC / Dt)
Donde C 1 y C 2 son concentraciones molares de sustancias en los tiempos t 1 y t 2, respectivamente (signo (+) - si la velocidad está determinada por el producto de reacción, signo (-) - por la sustancia de partida).
Las reacciones ocurren cuando las moléculas de sustancias que reaccionan chocan. Su velocidad está determinada por el número de colisiones y la probabilidad de que conduzcan a una transformación. El número de colisiones está determinado por las concentraciones de las sustancias que reaccionan y la probabilidad de una reacción está determinada por la energía de las moléculas que chocan.
Factores que influyen en la velocidad de las reacciones químicas.
1. La naturaleza de las sustancias reaccionantes. La naturaleza de los enlaces químicos y la estructura de las moléculas de los reactivos juegan un papel importante. Las reacciones proceden en la dirección de la destrucción de enlaces menos fuertes y la formación de sustancias con enlaces más fuertes. Por tanto, para romper los enlaces en las moléculas de H2 y N2, es necesario altas energías; tales moléculas son ligeramente reactivas. Romper enlaces en moléculas altamente polares (HCl, H 2 O) requiere menos energía y la velocidad de reacción es mucho mayor. Las reacciones entre iones en soluciones de electrolitos ocurren casi instantáneamente.
Ejemplos
El flúor reacciona explosivamente con el hidrógeno en temperatura ambiente, el bromo reacciona con el hidrógeno lentamente y cuando se calienta.
El óxido de calcio reacciona vigorosamente con el agua, liberando calor; Óxido de cobre: no reacciona.
2. Concentración. A medida que aumenta la concentración (el número de partículas por unidad de volumen), las colisiones de moléculas de sustancias que reaccionan ocurren con mayor frecuencia: la velocidad de reacción aumenta.
Ley de acción de masas (K. Guldberg, P. Waage, 1867)
La velocidad de una reacción química es directamente proporcional al producto de las concentraciones de los reactivos.
AA+bB+. . . ® . . .
- [A] a [B] b . . .
La constante de velocidad de reacción k depende de la naturaleza de los reactivos, la temperatura y el catalizador, pero no depende de las concentraciones de los reactivos.
El significado físico de la constante de velocidad es que es igual a la velocidad de reacción en concentraciones unitarias de los reactivos.
Para reacciones heterogéneas, la concentración de la fase sólida no se incluye en la expresión de la velocidad de reacción.
3. Temperatura. Por cada aumento de 10°C en la temperatura, la velocidad de reacción aumenta de 2 a 4 veces (regla de Van't Hoff). A medida que la temperatura aumenta de t 1 a t 2, el cambio en la velocidad de reacción se puede calcular mediante la fórmula:
| |
|
(t 2 - t 1) / 10 |
| Vt 2 / Vt 1 | = gramo | |
(donde Vt 2 y Vt 1 son las velocidades de reacción a temperaturas t 2 y t 1, respectivamente; g es el coeficiente de temperatura de esta reacción).
La regla de Van't Hoff sólo es aplicable en un rango de temperatura estrecho. Más precisa es la ecuación de Arrhenius:
- e-Ea/RT
Dónde
A es una constante que depende de la naturaleza de los reactivos;
R es la constante universal de los gases;
Ea es la energía de activación, es decir la energía que deben tener las moléculas en colisión para que la colisión conduzca a una transformación química.
Diagrama de energía de una reacción química.
| Reacción exotérmica | Reacción endotérmica |
A - reactivos, B - complejo activado (estado de transición), C - productos.
Cuanto mayor es la energía de activación Ea, más aumenta la velocidad de reacción al aumentar la temperatura.
4. Superficie de contacto de sustancias reaccionantes. Para sistemas heterogéneos (cuando las sustancias se encuentran en diferentes estados de agregación), cuanto mayor es la superficie de contacto, más rápida se produce la reacción. La superficie de los sólidos se puede aumentar triturándolos y de las sustancias solubles disolviéndolas.
5. Catálisis. Las sustancias que participan en las reacciones y aumentan su velocidad, permaneciendo sin cambios al final de la reacción, se denominan catalizadores. El mecanismo de acción de los catalizadores está asociado con una disminución de la energía de activación de la reacción debido a la formación de compuestos intermedios. En catálisis homogénea los reactivos y el catalizador constituyen una fase (están en el mismo estado de agregación), con catálisis heterogénea - diferentes fases(se encuentran en diferentes estados de agregación). Ralentizar drásticamente la progresión de enfermedades no deseadas. procesos quimicos en algunos casos, es posible añadir inhibidores al medio de reacción (el fenómeno " catálisis negativa").
DEFINICIÓN
Cinética química– el estudio de las velocidades y mecanismos de las reacciones químicas.
El estudio de las velocidades de reacción, la obtención de datos sobre los factores que influyen en la velocidad de una reacción química, así como el estudio de los mecanismos de las reacciones químicas se llevan a cabo de forma experimental.
DEFINICIÓN
Velocidad de reacción química– cambio en la concentración de una de las sustancias reaccionantes o productos de reacción por unidad de tiempo con un volumen constante del sistema.
Las velocidades de reacciones homogéneas y heterogéneas se definen de manera diferente.
La definición de una medida de la velocidad de una reacción química se puede escribir en forma matemática. Sea la velocidad de una reacción química en un sistema homogéneo, n B sea el número de moles de cualquiera de las sustancias resultantes de la reacción, V sea el volumen del sistema y sea el tiempo. Luego en el límite:
Esta ecuación se puede simplificar: la relación entre la cantidad de una sustancia y el volumen es la concentración molar de la sustancia n B / V = c B, de donde dn B / V = dc B y finalmente:
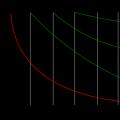
En la práctica, las concentraciones de una o más sustancias en ciertos intervalos tiempo. Las concentraciones de sustancias de partida disminuyen con el tiempo y las concentraciones de productos aumentan (Fig. 1).

Arroz. 1. Cambio en la concentración de la sustancia de partida (a) y del producto de reacción (b) con el tiempo.
Factores que afectan la velocidad de una reacción química.
Los factores que influyen en la velocidad de una reacción química son: la naturaleza de los reactivos, sus concentraciones, temperatura, presencia de catalizadores en el sistema, presión y volumen (en fase gaseosa).
La ley básica está asociada con la influencia de la concentración en la velocidad de una reacción química. cinética química– ley de acción de masas (LMA): la velocidad de una reacción química es directamente proporcional al producto de las concentraciones de las sustancias reaccionantes elevadas a la potencia de sus coeficientes estequiométricos. El ZDM no tiene en cuenta la concentración de sustancias en la fase sólida en sistemas heterogéneos.
Para la reacción mA +nB = pC +qD la expresión matemática del ZDM se escribirá:
K × C A m × C B n
K × [A] m × [B] n,
donde k es la constante de velocidad de una reacción química, que es la velocidad de una reacción química a una concentración de reactivos de 1 mol/l. A diferencia de la velocidad de una reacción química, k no depende de la concentración de los reactivos. Cuanto mayor es k, más rápida es la reacción.
La dependencia de la velocidad de una reacción química de la temperatura está determinada por la regla de Van't Hoff. Regla de Van't Hoff: por cada aumento de diez grados en la temperatura, la velocidad de la mayoría de las reacciones químicas aumenta aproximadamente de 2 a 4 veces. Expresión matemática:
(T 2) = (T 1) × (T2-T1)/10,
¿Dónde está el coeficiente de temperatura de Van't Hoff, que muestra cuántas veces aumenta la velocidad de reacción cuando la temperatura aumenta 10 o C?
Molecularidad y orden de reacción.
La molecularidad de una reacción está determinada por el número mínimo de moléculas que interactúan simultáneamente (participan en un acto elemental). Hay:
- reacciones monomoleculares (un ejemplo son las reacciones de descomposición)
N2O5 = 2NO2 + 1/2O2
K × C, -dC/dt = kC
Sin embargo, no todas las reacciones que obedecen a esta ecuación son monomoleculares.
- bimolecular
CH 3 COOH + C 2 H 5 OH = CH 3 COOC 2 H 5 + H 2 O
K × C 1 × C 2 , -dC/dt = k × C 1 × C 2
- trimolecular (muy raro).
La molecularidad de una reacción está determinada por su verdadero mecanismo. Es imposible determinar su molecularidad escribiendo la ecuación de una reacción.
El orden de la reacción está determinado por la forma de la ecuación cinética de la reacción. Es igual a la suma de los exponentes de los grados de concentración en esta ecuación. Por ejemplo:
CaCO 3 = CaO + CO 2
K × C 1 2 × C 2 - tercer orden
El orden de la reacción puede ser fraccionario. En este caso, se determina experimentalmente. Si la reacción avanza en una etapa, entonces el orden de la reacción y su molecularidad coinciden, si es en varias etapas, entonces el orden está determinado por la etapa más lenta y es igual a la molecularidad de esta reacción.
Ejemplos de resolución de problemas
EJEMPLO 1